เส้นทางการดูแล MCI due to AD ในเอเชีย: ความท้าทายและแนวทางแก้ไข
ภาวะความจำเสื่อมกำลังเป็นปัญหาสำคัญของเอเชีย
โรคอัลไซเมอร์และภาวะสมองเสื่อมกำลังกลายเป็นปัญหาสาธารณสุขที่สำคัญของโลก โดยเฉพาะในภูมิภาคเอเชียที่กำลังเผชิญกับการเพิ่มขึ้นอย่างรวดเร็วของจำนวนผู้ป่วย ข้อมูลระหว่างปี 1990 ถึง 2019 พบว่าอัตราการเกิดโรคอัลไซเมอร์และภาวะสมองเสื่อมในเอเชียตะวันออกและเอเชียแปซิฟิกเพิ่มขึ้นเร็วที่สุดในโลก คาดการณ์ว่าภายในปี 2050 จำนวนผู้ป่วยสมองเสื่อมทั่วโลกจะเพิ่มขึ้นจาก 57.4 ล้านคนในปี 2019 เป็น 152.8 ล้านคน โดยเอเชียใต้และเอเชียตะวันออกจะมีอัตราการเพิ่มขึ้นสูงถึง 6.2% และ 4.0% ตามลำดับ
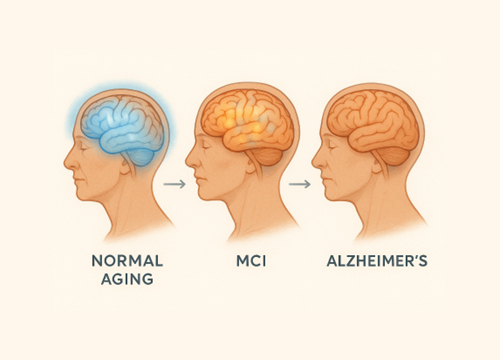
โรคอัลไซเมอร์เป็นโรคที่สมองเสื่อมไปทีละน้อย เริ่มต้นจากการสะสมของโปรตีนผิดปกติในสมอง (amyloid beta และ tau) ก่อนที่จะแสดงอาการทางคลินิก ระยะเวลาตั้งแต่เริ่มมีการเปลี่ยนแปลงในสมองจนกระทั่งแสดงอาการอาจใช้เวลานานถึง 20 ปี สิ่งที่น่าสนใจคือในช่วงระยะเริ่มต้นนี้ ผู้ป่วยจะมีอาการที่เรียกว่า “ภาวะการสูญเสียการรู้คิดเล็กน้อย ” หรือ Mild Cognitive Impairment (MCI) ซึ่งเป็นช่วงที่ผู้ป่วยเริ่มมีความจำหรือความคิดบกพร่องมากกว่าปกติตามวัย แต่ยังไม่รุนแรงพอที่จะจัดเป็นภาวะสมองเสื่อม
การค้นพบและรักษาผู้ป่วยในระยะ MCI จึงมีความสำคัญมาก เพราะเป็นจุดที่การแทรกแซงด้วยยารักษาโรคชนิดใหม่ (Disease-Modifying Therapies หรือ DMTs) อาจช่วยชะลอการดำเนินของโรคได้ ยาเหล่านี้ทำงานโดยการกำจัดโปรตีนผิดปกติที่สะสมในสมอง และผลการศึกษาทางคลินิกขนาดใหญ่แสดงให้เห็นว่ายาชนิด Disease-Modifying Therapies หรือ DMTs สามารถชะลอการเสื่อมของสมองในผู้ป่วย MCI และอัลไซเมอร์ระยะเริ่มต้นได้จริง
การศึกษาระบบดูแลผู้ป่วยในเอเชีย
เพื่อเตรียมความพร้อมสำหรับการใช้ยาชนิดใหม่เหล่านี้ โครงการ Asia PRIME ได้ทำการศึกษาเส้นทางการดูแลผู้ป่วย MCI จากอัลไซเมอร์ในภูมิภาคเอเชีย โดยสำรวจความคิดเห็นของแพทย์ผู้เชี่ยวชาญ 44 คน จาก 9 ประเทศ ได้แก่ ฮ่องกง อินเดีย อินโดนีเซีย เกาหลีใต้ มาเลเซีย ฟิลิปปินส์ สิงคโปร์ ไต้หวัน และไทย (ไม่รวมจีนแผ่นดินใหญ่และญี่ปุ่นที่มีการศึกษาแยกอยู่แล้ว) แพทย์ส่วนใหญ่เป็นแพทย์ประสาทวิทยา (70.5%) และมีประสบการณ์ในการดูแลผู้ป่วยมากกว่า 10 ปี
ผลการสำรวจพบว่าแพทย์แต่ละคนดูแลผู้ป่วย MCI เฉลี่ย 67.5 รายต่อเดือน โดย 24-87.5% ของผู้ป่วยเหล่านี้มี MCI ที่เกิดจากโรคอัลไซเมอร์ ผู้ป่วยส่วนใหญ่มาพบแพทย์ด้วยอาการหลักคือความจำเสื่อม แต่ก็มีอาการแทรกซ้อนอื่นๆ เช่น ความวิตกกังวล ซึมเศร้า หรือพฤติกรรมก้าวร้าวร่วมด้วย
กระบวนการตรวจวินิจฉัยในปัจจุบัน
เมื่อผู้ป่วยมาพบแพทย์ กระบวนการตรวจวินิจฉัยจะเริ่มจากการซักประวัติโดยละเอียด โดยเน้นไปที่การทำงานของสมองในแต่ละด้าน การตรวจร่างกายทางระบบประสาท และการประเมินว่าอาการต่างๆ ส่งผลกระทบต่อการใช้ชีวิตประจำวันหรือไม่ แพทย์เกือบทุกคน (93%) ใช้แบบทดสอบ Mini-Mental State Examination (MMSE) เป็นเครื่องมือคัดกรองเบื้องต้น ส่วนแบบทดสอบ Montreal Cognitive Assessment (MoCA) ถูกใช้น้อยกว่า (66%) และถูกมองว่าเป็นทางเลือกในหลายประเทศ ยกเว้นเกาหลีที่มีการใช้แบบทดสอบที่ครอบคลุมมากขึ้น เช่น Seoul Neuropsychological Screening Battery
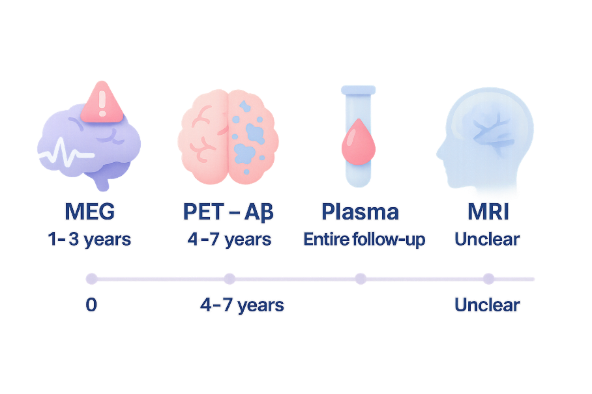
การถ่ายภาพสมองด้วย MRI ถูกใช้ในผู้ป่วยเกือบทั้งหมด (86-91%) และแพทย์เกือบทั้งหมด (91%) มองว่าเป็นการตรวจที่จำเป็น การถ่ายภาพด้วย CT ถูกใช้เป็นทางเลือกเมื่อผู้ป่วยไม่สามารถทำ MRI ได้ สิ่งที่น่าสนใจคือการตรวจหาสารชีวภาพ (biomarker) เพื่อยืนยันการสะสมของโปรตีนผิดปกติในสมอง ซึ่งเป็นเกณฑ์สำคัญในการวินิจฉัยอัลไซเมอร์อย่างแน่ชัด มีความแตกต่างกันมากระหว่างประเทศ
ในเกาหลีใต้ มีการใช้ amyloid PET scan ในผู้ป่วย 33% ซึ่งถือว่าสูงมาก ขณะที่ประเทศอื่นๆ ในเอเชียใช้เพียง 5% เท่านั้น การตรวจน้ำไขสันหลัง (CSF) เพื่อหาสารชีวภาพถูกใช้น้อยมากทั่วเอเชีย เนื่องจากเป็นการตรวจที่รุกล้ำ ผู้ป่วยเกรงกลัว และในหลายประเทศยังไม่มีบริการในทางคลินิก การตรวจเลือดหาสารชีวภาพที่กำลังพัฒนาขึ้นมาใหม่ยังไม่แพร่หลาย ยกเว้นในฟิลิปปินส์ที่มีการนำมาใช้อย่างจริงจัง
การตรวจยีน APOE ซึ่งเป็นปัจจัยเสี่ยงของโรคอัลไซเมอร์ ถูกใช้อย่างแพร่หลายในเกาหลี (100% ของแพทย์) และถูกมองว่าเป็นส่วนสำคัญของการวินิจฉัย แต่ในประเทศอื่นๆ มีการใช้เพียง 50% และมองว่าเป็นทางเลือกมากกว่าความจำเป็น ระยะเวลาในการวินิจฉัยแตกต่างกันไปตั้งแต่ 1-6 เดือน โดยในเกาหลีใช้เวลาเฉลี่ย 2.8 เดือน แต่อาจนานถึง 6 เดือนหากต้องรอการตรวจประเมินทางจิตวิทยาที่ละเอียด
การรักษาและติดตามผู้ป่วย
เมื่อวินิจฉัยแล้ว แพทย์ทุกคนมองว่าเป้าหมายของการรักษาคือการชะลอการดำเนินของโรคไม่ให้กลายเป็นภาวะสมองเสื่อมเต็มรูปแบบ อย่างไรก็ตาม สิ่งที่ผู้ป่วยและครอบครัวคาดหวังส่วนใหญ่คือการรักษาให้หายขาด ซึ่งในปัจจุบันยังเป็นไปไม่ได้
ในด้านการรักษาด้วยยา ผู้ป่วย 96%-69% ได้รับยา ยาที่ใช้ส่วนใหญ่เป็นกลุ่ม nootropics (ยาบำรุงสมอง) และยาประเภท acetylcholinesterase inhibitors
นอกจากยาแล้ว การรักษาแบบไม่ใช้ยามีความสำคัญมากและถูกแนะนำให้กับผู้ป่วยเกือบทุกราย (93-100%) โดยเน้นไปที่การปรับเปลี่ยนวิถีชีวิต ได้แก่ การออกกำลังกาย (95-100% ของผู้ป่วย) การทำกิจกรรมที่กระตุ้นสมองและการมีปฏิสัมพันธ์ทางสังคมอย่างต่อเนื่อง (95-100%) การปรับเปลี่ยนอาหาร (64-74%) และการเลิกสูบบุหรี่และเครื่องดื่มแอลกอฮอล์ (69-74%) การแทรกแซงทางจิตวิทยา เช่น การฝึกทักษะความคิด (cognitive interventions) ถูกแนะนำให้กับผู้ป่วย 61-66% ส่วนการจิตบำบัดถูกแนะนำเพียง 17-25% เท่านั้น
การติดตามผลผู้ป่วยมีการนัดทุก 3-6 เดือน ซึ่งแพทย์ส่วนใหญ่ (98%) มองว่าเหมาะสมกับการดำเนินของโรคที่ค่อนข้างช้า การทำแบบทดสอบทางจิตวิทยาซ้ำมีความถี่ตั้งแต่ทุก 3-6 เดือนในบางประเทศ จนถึงทุกปีในเกาหลี การถ่าย MRI ซ้ำมักทำเฉพาะเมื่อมีอาการแย่ลงอย่างรวดเร็วหรือสงสัยว่าอาจมีภาวะอื่นแทรกซ้อน
อุปสรรคและความท้าทายที่พบ
การศึกษานี้ชี้ให้เห็นอุปสรรคที่สำคัญหลายประการในการดูแลผู้ป่วย MCI จากอัลไซเมอร์ในเอเชีย ซึ่งแตกต่างกันไปในแต่ละประเทศ แพทย์ระบุว่าการค้นพบผู้ป่วยในประเทศของตนเป็นไปอย่างรวดเร็วและมีประสิทธิภาพ สะท้อนถึงผลสำเร็จของนโยบายสาธารณสุขระดับชาติที่ดำเนินการมาตั้งแต่ปี 2008 โดยมีการอัพเดตแผนงานมาแล้ว 4 ครั้ง รวมถึงการขยายความคุ้มครองประกันสุขภาพให้ครอบคลุมถึง 90% ของค่ารักษาโรคสมองเสื่อม การเปิดศูนย์สนับสนุนผู้ป่วยสมองเสื่อมกว่า 256 แห่งทั่วประเทศ และการขยายระบบประกันการดูแลระยะยาว
ตรงกันข้าม แพทย์ในประเทศอื่นๆ (36% ของผู้ตอบแบบสอบถาม) ระบุว่าการค้นพบผู้ป่วยยังไม่เพียงพอ สาเหตุหลักมาจากผู้ป่วยและครอบครัวขาดความรู้ความเข้าใจเกี่ยวกับโรค มักคิดว่าการที่ความจำเสื่อมเป็นเรื่องปกติของวัยชรา จึงไม่รีบมาพบแพทย์ สิ่งนี้ส่งผลให้เสียเวลาอันมีค่าในการเริ่มรักษาตั้งแต่ระยะแรก
อุปสรรคสำคัญอีกประการหนึ่งคือการเข้าถึงบริการตรวจวินิจฉัย มีรายงานว่าผู้ป่วยต้องรอนานกว่าจะได้เข้ารับการตรวจ (16% ของผู้ตอบแบบสอบถาม) นอกจากนี้ยังมีปัญหาคิวรอการถ่ายภาพสมอง ปัญหาหลักคือการขาดแคลนบุคลากรและเวลารอที่ยาวนานสำหรับการทำแบบทดสอบทางจิตวิทยาที่ครอบคลุม การขาดแคลนบุคลากรในการทำการทดสอบทางจิตวิทยา
การเข้าถึงการตรวจหาสารชีวภาพที่ยืนยันการสะสมของโปรตีนผิดปกติมีความแตกต่างกันมากระหว่างประเทศ ในเกาหลี amyloid PET มีบริการพร้อมแต่มีราคาแพง แพทย์ 14% เสนอว่าควรมีการจ่ายคืนค่ารักษาจากประกันสุขภาพ ส่วนในอินเดีย อินโดนีเซีย และมาเลเซีย (16% ของผู้ตอบแบบสอบถาม) ยังไม่มีบริการ amyloid PET เลย การตรวจน้ำไขสันหลังไม่เป็นที่นิยมทั่วเอเชียเนื่องจากเป็นการตรวจที่รุกล้ำ และในหลายประเทศ (ฮ่องกง อินโดนีเซีย มาเลเซีย ฟิลิปปินส์ สิงคโปร์ และไต้หวัน รวม 32% ของผู้ตอบแบบสอบถาม) ยังไม่มีบริการในทางคลินิก
การเตรียมพร้อมสำหรับยารักษาโรคชนิดใหม่
แพทย์ทุกคนเห็นพ้องว่าเมื่อยา DMTs ที่กำจัดโปรตีน amyloid เข้ามาใช้ได้จริง จะต้องมีการตรวจหาสารชีวภาพมากขึ้น (80% ของผู้ตอบแบบสอบถาม) ไม่ว่าจะเป็น amyloid PET การตรวจเลือด หรือการตรวจน้ำไขสันหลัง เพื่อคัดเลือกผู้ป่วยที่เหมาะสมกับการรักษา แพทย์ในเกาหลี (50% ของแพทย์ในเกาหลี) เน้นย้ำความสำคัญของการรักษาผู้ป่วยให้เร็วที่สุดเพื่อชะลอการดำเนินของโรค ส่วนแพทย์จากประเทศอื่นๆ (100% ของแพทย์นอกเกาหลี) เห็นตรงกันว่ายาเหล่านี้จะเป็นประโยชน์อย่างมากในการรักษาผู้ป่วย MCI จากอัลไซเมอร์
อย่างไรก็ตาม การศึกษาในประเทศที่พัฒนาแล้วเช่นสหรัฐอเมริกาและยุโรปพบว่าระบบสาธารณสุขยังไม่พร้อมรองรับยาชนิดใหม่ เนื่องจากมีข้อจำกัดด้านกำลังคน โครงสร้างพื้นฐาน และระยะเวลารอคอยที่ยาวนาน การคาดการณ์แสดงว่าผู้ป่วยจำนวนมากอาจพัฒนาเป็นสมองเสื่อมเต็มรูปแบบขณะรอรับการรักษา หากไม่มีการปรับปรุงระบบ ในญี่ปุ่น แม้จะมียาเข้ามาใช้แล้วและมีผู้ป่วยได้รับยาไปกว่า 4,500 คนตั้งแต่เดือนพฤศจิกายน 2024 แต่ก็ยังมีความท้าทายในการจัดลำดับความสำคัญของผู้ป่วยและการเข้าถึงการตรวจต่างๆ
ข้อเสนอแนะจากผู้เชี่ยวชาญ
จากผลการศึกษานี้และประสบการณ์ของผู้เชี่ยวชาญ มีข้อเสนอแนะสำคัญหลายประการเพื่อปรับปรุงระบบการดูแลผู้ป่วย MCI จากอัลไซเมอร์ในเอเชีย
ข้อแรกและสำคัญที่สุดคือการให้ความรู้แก่ผู้ป่วย ผู้ดูแล และประชาชนทั่วไป เกี่ยวกับ MCI และโรคอัลไซเมอร์ รวมถึงประโยชน์ของการค้นพบเร็ว สุขภาพสมอง ปัจจัยเสี่ยงของโรคสมองเสื่อม และความสำคัญของการปรับเปลี่ยนวิถีชีวิต การให้ความรู้จะช่วยลดความอับอายและความเข้าใจผิดเกี่ยวกับภาวะความจำเสื่อม นอกจากนี้ ควรมีการรณรงค์สร้างความตระหนักรู้สาธารณะเพื่อกระตุ้นให้ผู้คนมาตรวจสุขภาพเชิงรุก
ข้อที่สอง คือการเสริมสร้างศักยภาพของโรงพยาบาลระดับปฐมภูมิและทุติยภูมิให้สามารถค้นพบและประเมินผู้ป่วย MCI ได้อย่างเหมาะสม ซึ่งต้องอาศัยการให้ความรู้แก่บุคลากรทางการแพทย์ รวมถึงแพทย์เวชปฏิบัติทั่วไป พยาบาล และเจ้าหน้าที่สนับสนุนอื่นๆ เกี่ยวกับสารชีวภาพของโรคอัลไซเมอร์ การตรวจต่างๆ และการรักษาที่มีอยู่ ข้อเสนอแนะล่าสุดแนะนำให้แบ่งหน้าที่ระหว่างแพทย์เวชปฏิบัติทั่วไปกับแพทย์เชี่ยวชาญ โดยแพทย์ปฐมภูมิจะทำหน้าที่คัดกรองและประเมินอาการเบื้องต้น ส่วนแพทย์เชี่ยวชาญจะทำหน้าที่ยืนยันด้วยสารชีวภาพ ให้การรักษา และติดตามผล
ข้อที่สาม คือการพัฒนาและขยายบริการประเมินทางจิตวิทยาและความคิด โดยควรมีการฝึกอบรมนักจิตวิทยาคลินิกเพิ่มขึ้น เพื่อให้สามารถทำแบบทดสอบที่ครอบคลุมและตีความผลได้อย่างมาตรฐาน นอกจากนี้ ควรมีการจัดลำดับความสำคัญของผู้ป่วยโดยอิงจากแบบทดสอบคัดกรองและปัจจัยเสี่ยงอื่นๆ เพื่อให้ผู้ป่วยที่มีความเสี่ยงสูงได้รับการตรวจประเมินอย่างละเอียดก่อน
ข้อที่สี่ คือการปรับปรุงการเข้าถึงและการใช้การตรวจหาสารชีวภาพ การ ตรวจเลือดหาสารชีวภาพที่กำลังพัฒนาขึ้นมีศักยภาพสูงเพราะราคาถูกกว่าและทำง่ายกว่า อาจช่วยแก้ปัญหาข้อจำกัดด้านทรัพยากรได้ แต่ยังต้องการหลักฐานจากการใช้งานจริงและแนวทางปฏิบัติเพื่อสนับสนุนการใช้งานทางคลินิก สำหรับ amyloid PET จำเป็นต้องมีการขยายบริการและจัดระบบการชำระเงินที่เหมาะสม โดยต้องวางแผนโครงสร้างพื้นฐานอย่างรอบคอบ คำนึงถึงความต้องการที่อาจลดลงในระยะยาวเมื่อมีการตรวจทางเลือกอื่นเข้ามา
ข้อที่ห้า คือการพัฒนาแนวทางปฏิบัติในการใช้สารชีวภาพและการรักษาอย่างเหมาะสม โดยควรมีการพัฒนาอัลกอริทึมการตรวจและแนวทางปฏิบัติที่ดีที่สุดโดยผู้เชี่ยวชาญในระดับประเทศหรือภูมิภาค รวมถึงแผนการรักษาสำหรับผู้ป่วย MCI ที่เกิดจากสาเหตุอื่นด้วย นอกจากนี้ ควรมีการประสานงานในระดับโลกเพื่อสร้างมาตรฐานในการคัดกรองและวินิจฉัยโดยใช้สารชีวภาพ
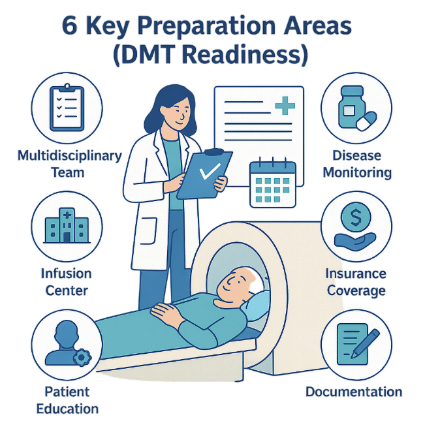
ข้อเสนอแนะเฉพาะสำหรับการเตรียมพร้อมรองรับยา DMTs ครอบคลุม 6 ด้านหลัก ได้แก่
การคัดเลือกและระบุตัวผู้ป่วยที่เหมาะสม การจัดการรักษา โครงสร้างพื้นฐานและทรัพยากร การให้ความรู้และสนับสนุนผู้ป่วย การทำงานร่วมกันระหว่างสหสาขาวิชาชีพ และการวิจัยและปรับปรุงคุณภาพ
สำหรับการจัดการรักษา จำเป็นต้องมีโปรโตคอลมาตรฐานสำหรับการให้ยา การติดตามผลการตอบสนองต่อการรักษา และการตรวจสอบผลข้างเคียง โดยเฉพาะ ARIA (amyloid-related imaging abnormalities) ซึ่งเป็นภาวะที่สำคัญและอาจเกิดขึ้นจากยา DMTs การติดตาม ARIA ต้องใช้ MRI ที่มีลำดับภาพพิเศษ ซึ่งอาจเป็นความท้าทายในบางประเทศที่ยังไม่มีการชำระเงินคืนสำหรับ MRI ในการติดตามผู้ป่วย MCI
ด้านโครงสร้างพื้นฐาน ควรมีการจัดตั้งคลินิกสมองเสื่อมเฉพาะทางหรือศูนย์ความเป็นเลิศ พร้อมทั้งให้การศึกษาแก่บุคลากรทางการแพทย์เกี่ยวกับยา DMTs การคัดเลือกผู้ป่วย การติดตามการรักษา และการจัดการผลข้างเคียง
การให้ความรู้ผู้ป่วยและผู้ดูแลเกี่ยวกับยาเหล่านี้ รวมถึงประโยชน์ ข้อจำกัด และความเสี่ยงที่อาจเกิดขึ้น เป็นสิ่งสำคัญที่จะช่วยให้มีการตัดสินใจร่วมกันได้อย่างเหมาะสม
การทำงานร่วมกันระหว่างแพทย์หลายสาขา ได้แก่ ประสาทวิทยา จิตเวช เวชศาสตร์ผู้สูงอายุ แพทย์ฉุกเฉิน และแพทย์เวชปฏิบัติทั่วไป เป็นสิ่งจำเป็นเพื่อให้การดูแลที่ครอบคลุม นอกจากนี้ ควรมีการสื่อสารที่มีประสิทธิภาพระหว่างผู้ให้บริการสาธารณสุข ผู้จ่ายเงิน และผู้กำหนดนโยบาย เพื่อให้แน่ใจว่าผู้ป่วยสามารถเข้าถึงการรักษาได้อย่างเท่าเทียม
ควรมีการจัดทำระบบทะเบียนและเก็บรวบรวมข้อมูลจากการใช้งานจริงของยา DMTs เพื่อนำมาวิเคราะห์ประสิทธิผล ความปลอดภัย และผลลัพธ์ในผู้ป่วย
สรุป
การศึกษา Asia PRIME แสดงให้เห็นภาพรวมที่สำคัญของสถานการณ์การดูแลผู้ป่วย MCI จากโรคอัลไซเมอร์ในเอเชีย แม้จะมีความแตกต่างระหว่างประเทศ โดยเฉพาะเกาหลีใต้ที่มีระบบที่พัฒนาแล้วเนื่องจากมีนโยบายระดับชาติที่ชัดเจนมาอย่างยาวนาน แต่โดยรวมแล้วภูมิภาคเอเชียยังมีความท้าทายหลายประการที่ต้องแก้ไข กระบวนการคัดกรองและการวินิจฉัยยังต้องปรับปรุงให้ดีขึ้น โดยเฉพาะการเพิ่มความตระหนักรู้ในหมู่ประชาชน การเสริมสร้างศักยภาพของบุคลากรทางการแพทย์ และการขยายบริการตรวจวินิจฉัยต่างๆ
การเข้าถึงการตรวจหาสารชีวภาพที่ยืนยันการสะสมของโปรตีน amyloid ยังจำกัดมากในหลายประเทศ ซึ่งจะเป็นอุปสรรคสำคัญต่อการใช้ยา DMTs ที่กำลังจะเข้ามา การขยายการให้บริการและจัดระบบการชำระเงินที่เหมาะสมสำหรับการตรวจเหล่านี้จึงเป็นสิ่งจำเป็นเร่งด่วน พร้อมกันนี้ การพัฒนาการตรวจเลือดหาสารชีวภาพที่ง่ายและถูกกว่าอาจเป็นทางออกที่ดีสำหรับหลายประเทศ
ยาชนิดใหม่ที่สามารถชะลอการดำเนินของโรคได้กำลังจะเข้ามามีบทบาทในการรักษาโรคอัลไซเมอร์ระยะเริ่มต้น ดังนั้น ประเทศต่างๆ ในเอเชียจึงจำเป็นต้องเตรียมความพร้อมอย่างจริงจังทั้งในด้านโครงสร้างพื้นฐาน บุคลากร และระบบการให้บริการ เพื่อให้แน่ใจว่าผู้ป่วยที่เหมาะสมจะได้รับการรักษาอย่างทันท่วงทีและปลอดภัย การทำงานร่วมกันระหว่างหน่วยงานต่างๆ ตั้งแต่ภาครัฐ ผู้ให้บริการสาธารณสุข ผู้จ่ายเงิน และผู้กำหนดนโยบาย จะเป็นกุญแจสำคัญในการบรรลุเป้าหมายนี้
การลงทุนในการให้ความรู้ การพัฒนาบุคลากร และการปรับปรุงโครงสร้างพื้นฐานในวันนี้ จะเป็นการวางรากฐานที่มั่นคงสำหรับการดูแลผู้ป่วยโรคอัลไซเมอร์ในอนาคต ซึ่งจะช่วยให้ผู้ป่วยและครอบครัวมีคุณภาพชีวิตที่ดีขึ้น และลดภาระของโรคที่กำลังเพิ่มสูงขึ้นอย่างรวดเร็วในภูมิภาคเอเชีย
เอกสารอ้างอิง
Choi SH, Kim S, Ong PA, Chin AV, Dominguez J, Chen CL, et al. The patient pathway for mild cognitive impairment due to Alzheimer’s disease in Asia: Current practices, barriers, and expert recommendations for optimization. J Prev Alzheimers Dis. 2025;12(1):100215